AROMÁTICOS, ALCANOS, ALQUENOS, ALQUINOS
INTRODUCCIÓN
OBJETIVOS
-Dar a conocer los temas propuestos
- Realizar correctamente el repaso del tema
MARCO TEÓRICO
AROMÁTICOS
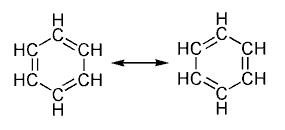 Un hidrocarburo aromático o areno es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π. Para determinar esta característica se aplica la regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en consideración de la topología de superposición de orbitales de los estados de transición. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
Un hidrocarburo aromático o areno es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π. Para determinar esta característica se aplica la regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en consideración de la topología de superposición de orbitales de los estados de transición. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
Propiedades y usos de los alcanos.-


























Los alcanos, alquinos y alquenos son unos Hidrocarburos, en química orgánica, familia de compuestos orgánicos que contienen carbono e hidrógeno. Son los compuestos orgánicos más simples y pueden ser considerados como las sustancias principales de las que se derivan todos los demás compuestos orgánicos.
Se especula que le dio este nombre en honor de una amiga llamada bárbara.
La ciencia química fue avanzando y el gran número de compuestos orgánicos descubiertos hicieron imprescindible el uso de una nomenclatura sistemática.
En el sistema IUPAC de nomenclatura un nombre está formado por tres partes: prefijos, principal y sufijos; Los prefijos indican los sustituyentes de la molécula; el sufijo indica el grupo funcional de la molécula; y la parte principal el número de carbonos que posee.
-Dar a conocer los temas propuestos
- Realizar correctamente el repaso del tema
MARCO TEÓRICO
AROMÁTICOS
 Un hidrocarburo aromático o areno es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π. Para determinar esta característica se aplica la regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en consideración de la topología de superposición de orbitales de los estados de transición. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
Un hidrocarburo aromático o areno es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π. Para determinar esta característica se aplica la regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en consideración de la topología de superposición de orbitales de los estados de transición. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
Originalmente el término estaba restringido a un producto del alquitrán mineral, el benceno, y a sus derivados, pero en la actualidad incluye casi la mitad de todos los compuestos orgánicos; el resto son los llamados compuestos alifáticos. El exponente emblemático de la familia de los hidrocarburos aromáticos es el benceno (C6H6), pero existen otros ejemplos, como la familia de anulenos, hidrocarburos monocíclicos totalmente conjugados de fórmula general (CH)n.
ALQUENOS
Los alquenos son hidrocarburos alifáticos que poseen un doble enlace entre dos átomos de carbono consecutivos. El doble enlace es un punto reactivo o un grupo funcional y es el que determina principalmente las propiedades de los alquenos.
Los alquenos también se conocen como hidrocarburos insaturados (tienen menos hidrógeno que el máximo posible). Un antiguo nombre de esta familia de compuestos es oleofinas.
Propiedades Físicas
- 1. Estado Físico: los tres primeros miembros son gases a temperatura ordinaria, del C5 hasta el C18 son líquidos y los demás sólidos.
- 2. Puntos de Ebullición: son un poco más bajos (algunos grados) que los alcanos.
- 3. Puntos de Fusión: son ligeramente mayores que el de los alcanos.
- 4. Densidad: un poco más alta que la de los alcanos.
- 5. Solubilidad: la solubilidad de los alquenos en agua, aunque debil, es considerablemente más alta que la de los alcanos, debido a que la concentración de los electrones en el doble enlace, produce una mayor atracción del extremo positivo del dipolo de la molécula de agua.
Reacciones ó Propiedades Químicas
- 1. Combustión: en presencia del calor producido por una llama, los alquenos reaccionan con el oxígeno atmosférico, originando dióxido de carbono (g) y agua. Esto constituye una combustión completa. En la reacción se libera gran cantidad de calor.
- 2. Adición de un reactivo isométrico: X2 (H2, Cl2, Br2).
- Hidrogenación: adición de una molécula de hidrógeno (H2 ó H-H)
Los alquenos al ponerlos en contacto con el hidrógeno (H2) en presencia de un catalizador tal como el Pt, Pd ó Ni finalmente divididos, dan origen a alcanos.
 El doble enlace se rompe.
El doble enlace se rompe.- Halogenación: adición de una molécula de halógeno (X2, donde X es F, Cl, Br ó I).
Los alquenos reaccionan con el bromo (Br - Br), disuelto en tetracloruro de carbono (CCl4), a temperatura ambiente y en ausencia de luz. Se forma un compuesto cuyo nombre general es dihalogenuro vecinal ó dihaluro vecinal (vic-dihaluro). Se sabe que la reacción se ha efectuado, porque el color rojo pardo del bromo en el CCl4 desaparece casi instantáneamente. La reacción de adición se presenta así: El bromo disuelto en CCl4 es un reactivo útil para distinguir entre alquenos y alcanos, ya que estos últimos no reaccionan con él.
El bromo disuelto en CCl4 es un reactivo útil para distinguir entre alquenos y alcanos, ya que estos últimos no reaccionan con él.- Adición de haluros de hidrógeno: HY = HX, donde X es Cl, Br ó I
La adición de haluros de hidrógeno al doble enlace de un alqueno, da lugar al derivado monohalogenado llamado halogenuro de alquilo o haluro de alquilo, de fórmula general RX. Si el alqueno es simétrico se aplica la regla de Markonikov.
- Adición de ácido sulfúrico: H2SO4 (H – OSO3H)
Cuando los alquenos se tratan en frío con ácido sulfúrico concentrado, reaccionan por adición (sigue la regla de Markonikov), formando el sulfato ácido de alquilo correspondiente de fórmula ROSO3H.
- Adición de ozono (O3): ozonólisis
Se utiliza esta reacción para localizar el doble enlace. La reacción del ozono con un alqueno conduce a la formación de un ozónido. Algunos ozónidos son inestables cuando están secos y pueden explotar con gran violencia. Ordinariamente no se aislan, sino que la mezcla de reacción se trata en condiciones reductoras, dando aldehidos y cetonas como productos.
ALQUINOS
Los alquinos son hidrocarburos alifáticos que poseen un triple enlace entre dos átomo de carbono adyacentes. El triple enlace es un punto reactivo o un grupo funcional y es el que determina principalmente las propiedades de los alquinos. Los alquinos también se conocen como hidrocarburos acetilénicos, debido a que el primer miembro de esta serie homóloga es el acetileno o etino.
Propiedades Físicas
- 1. Estado Físico: son gases hasta el C5, líquidos hasta el C15 y luego sólidos
- 2. Puntos de Ebullición: son más altos que los de los correspondientes alquenos y alcanos
- 3. Puntos de Fusión: se puede decir lo mismo que para el punto de ebullición
- 4. Densidad: igual que en los casos anteriores
- 5. Solubilidad: se disuelven en solventes no polares
Reacciones ó Propiedades Químicas
El triple enlace es menos reactivo que el doble enlace.
- 1. Combustión: en presencia de calor producido por una llama, los alquinos reaccionan con el oxígeno atmosférico, originando dioxido de carbono (g) y agua, lo cual constituye una combustión completa. En la reacción se libera gran cantidad de calor.
- 2. Hidrogenación: la hidrogenación catalítica (Ni, Pt, Pd) conduce primero a la formación de un alqueno y luego a la del alcano correspondiente.
- 3. Halogenación: los alquinos en presencia de un catalizador reaccionan con dos moléculas de halógeno, originando los tetrahaluros de alquilo.
- 4. Adición de haluros de hidrógeno (HCl, HBr): la adición de haluros de hidrógeno al triple enlace, conduce a la formación de dihaluro geminal.
- 5. Adición de agua: se utiliza para formar etanal (aldehído con dos átomos de carbono), el cual puede oxidars luego a ácido acético (ácido orgánico con dos átomo de carbono). La reacción se lleva a cabo utilizando H2SO4 y HgSO4 como catalizadores. La adición de agua a otros alquinos no origina aldehídos, sino cetonas, ya que el –OH se fija al carbono menos hidrogenado.
- 6. Los alquinos como ácidos: los metales alcalinos como el Na y K desplazan los hidrógenos del acetileno (hidrógenos ácidos). Los alquinos terminales forman tambien derivados metálicos con plata e iones cuprosos. Este enlace metal-carbono en los alquilaros de plata y cobre es principalmente covalente, como resultado de ellos son bases débiles u nucleófilos débiles. Estas reacciones se usan para reconocer el etino y demás alquinos con triple enlace Terminal.
- 7. Oxidación de los alquinos: cuando los alquinos se tratan con el reactivo Baeyer sufren una ruptura oxidativa en forma similar a la que se produce en los alquenos. Los productos de la reacción (después de la acidificación) son ácidos carboxílicos fáciles de identificar. Esta reacción permite localizar la posición del triple enlace en un alquino.
ALCANOS
Los alcanos son hidrocarburos, es decir que tienen sólo átomos de carbono e hidrógeno. La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados de cadena abierta que tiene enlaces sencillos: carbono-carbono y carbono-hidrogeno.
Quizá en tu casa, para calentar el agua y preparar los alimentos empleas gas que esta contenido en tanques. Pues bien , ese es un alcano, lo te indica que emplea como combustible. Los alcanos, en términos generales, es utilizan como combustible, pero también se usan para fabricar plástico, disolvente, negro de humo (tinta) etcétera.
Propiedades y usos de los alcanos.-
- El estado físico de los 4 primeros alcanos: metano, etano, propano y butano es gaseoso. Del pentano al hexadecano (16 átomos de carbono) son líquidos y a partir de heptadecano (17 átomos de carbono) son sólidos.
- El punto de fusión, de ebullición y la densidad aumentan conforme aumenta el número de átomos de carbono.
- Son insolubles en agua
- Pueden emplearse como disolventes para sustancias poco polares como grasas, aceites y ceras.
- El gas de uso doméstico es una mezcla de alcanos, principalmente propano.
- El gas de los encendedores es butano.
- El principal uso de los alcanos es como combustibles debido a la gran cantidad de calor que se libera en esta reacción.
LABORATORIO IDENTIFICACIÓN DE HIDROCARBUROS
EDUCAPLAY
LABORATORIO









LE FALTÓ MÁS CONSULTA PARA MARCO TEÓRICO DE AROMÁTICOS LAS OTRAS TEMATICAS NO CORRESPONDEN AL TRABAJO 3,5
ResponderEliminar