REACCIONES Y ECUACIONES QUÍMICAS
INTRODUCCIÓN:
La química como tal, se representa por medio de reacciones, ecuaciones, símbolos y formas; razón por la cual hemos decidido estudiar las reacciones y ecuaciones químicas, que son, sus tipos y en dónde aparecen.
OBJETIVOS:
- Conocer por medio de la internet, cuáles y qué son las reacciones y ecuaciones químicas.
- Distinguir entre ecuación y reacción química.
- Conocer la forma en la que trabajan las reacciones y las ecuaciones, sus características y tipos.
REACCIONES QUÍMICAS: concepto
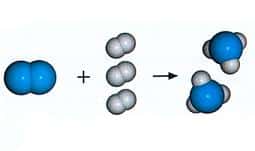
La reacción química es aquel proceso químico en el cual dos
sustancias o más, denominados reactivos, por la acción de un factor energético,
se convierten en otras sustancias designadas como productos. Mientras tanto,
las sustancias pueden ser elementos químicos (materia constituida por átomos de
la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos
o más elementos de la tabla periódica).
En una reacción
química se desencadena el proceso de ruptura de enlaces químicos creando
espontáneamente, o por manipulación, una nueva ecuación o sustancia química.
Por lo tanto, en una reacción química se deben juntar, mezclar o manipular las
sustancias reactantes para la creación de productos químicos.
PARTES DE LA REACCIÓN QUÍMICA:
La reacción química tiene dos partes que son: - REACTANTE O REACTIVO: Son aquellas sustancias que desarrollan una interacción con otras en una reacción química produciendo otras sustancias con características, propiedades y conformación diferente a las que se les llama productos o productos de reacción. Los reactivos son compuestos químicos que se clasifican tomando en cuenta distintas variables, tales como la reactividad en reacciones químicas, las propiedades fisicoquímicas y las características del uso del reactivo.
- PRODUCTO: Son los químicos que resultan de la separación y reacomodación de los reactivos. Estos aparecen al lado derecho de la ecuación en la reacción química. De forma general, los productos son moléculas mucho más estables que los reactivos. Algo importante a tener en cuenta es que la distinción entre los productos y los reactivos no es muy clara debido a que estas reacciones se llevan a cabo a manera de equilibrio, esto significa que hay un proceso de ida y regreso entre los productos y los reactivos. El resultado final es que algunos de los reactivos pueden combinarse para resultar en productos, sin embargo, estos químicos pueden volver a reaccionar para terminar formando los reactivos de nuevo. Cuando esta clase de reacción llega al equilibrio, los reactivos y los productos coexisten juntamente y se mantienen en variación constante entre ambos estados.
TIPOS DE REACCIONES: concepto
- Reacción de síntesis o combinación: Se presenta una reacción entre los reactivos ya sean elementos o compuestos, y se transforman en la unión de dichos elementos o compuestos en un sólo producto, por ejemplo:
A+B→C
- Reacciones de descomposición: Se presenta en una ecuación, que a partir de un compuesto se obtienen dos o más sustancias simples, es decir:
C→A+B
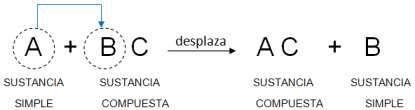
- Reacciones de sustitución simple: Para éstas reacciones de sustitución o desplazamiento, los reactivos más activos desplazan a los menos activos, ocupando el lugar del menor, ejemplo:
C+AB→CB+A
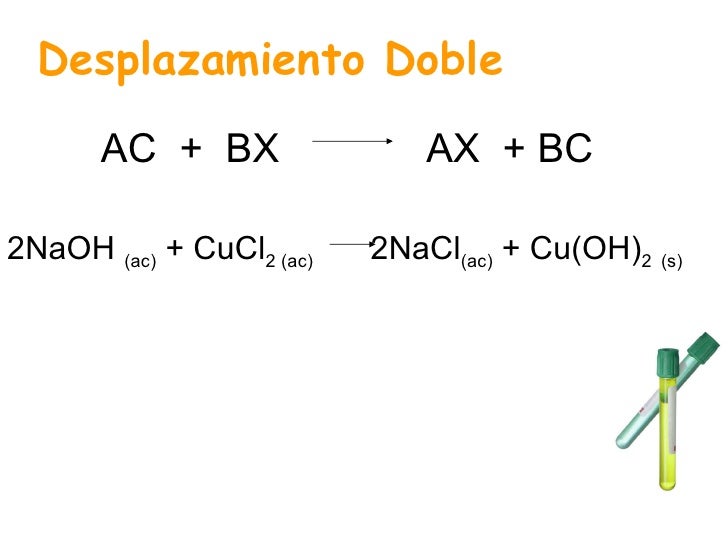
- Reacciones de desplazamiento doble: Se da en una ecuación donde los dos reactivos se transforman en dos compuestos nuevos, sin cambiar el estado de oxidacion de los elementos.
AB+CD→AD+CB
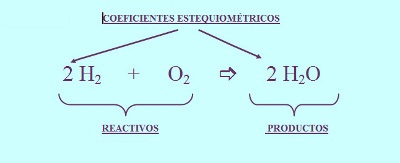
ECUACIÓN QUÍMICA: CONCEPTO
Es una descripción simbólica de una reacción
química. Muestra las sustancias que reaccionan
(llamadas reactivos ) y las sustancias que
se originan (llamadas productos). La ecuación química ayuda a visualizar los
reactivos que son los que tendrán una reacción química y los productos, que son
las sustancias que se obtienen de este proceso. Además se pueden ubicar los
símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos
con mayor facilidad.
Para escribir una ecuación química, es necesario tener en cuenta los siguientes aspectos:
1. Se escribe en forma de
ecuación sustituyendo el signo de igualdad (=) por una flecha (→) que indica el sentido
de la misma.
2. Se agrupan los átomos de modo que se facilite la lectura de la misma.
3. Se ajusta la ecuación de modo que quede equilibrada.
4. Es necesario recordar que un requisito para que sea ecuación, es que tiene la misma cantidad de átomos de cada sustancia en cada uno de los lados que representa.
BALANCEO DE ECUACIONES
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos"
Veremos 3 tipos de balanceo de ecuaciones químicas: Balanceo por TANTEO, OXIDO-REDUCCIÓN (REDOX) Y MATEMATICO O ALGEBRAICO:
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
-
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
-
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
-
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
-
4. Los alcalinos tienen en sus compuestos oxidación +1
-
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
-
6. Los alógenos tienen en sus compuestos con aluros oxidación -1
-
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
-
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
BALANCEO DE ECUACIONES
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos"
Veremos 3 tipos de balanceo de ecuaciones químicas: Balanceo por TANTEO, OXIDO-REDUCCIÓN (REDOX) Y MATEMATICO O ALGEBRAICO:
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
- 1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
- 2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
- 3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
- 4. Los alcalinos tienen en sus compuestos oxidación +1
- 5. Los alcalinotérreos tienen en sus compuestos oxidación +2
- 6. Los alógenos tienen en sus compuestos con aluros oxidación -1
- 7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
- 8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
CONCLUSIONES:
- La reacción química es la suma de dos sustancias, éstas crean un producto.Por otro lado, la ecuación química es una reacción química que ha sido equilibrada.
- Por medio de éste blog, hemos conocido las características y partes de las ecuaciones y reacciones químicas.
WEB GRAFÍA:
- http://www.iered.org/archivos/Proyecto_coKREA/REAfinales2014/ReaccionesQuimicas_MagalyHenao/clases_de_reacciones_qumicas.html
- https://www.uv.es/madomin/miweb/ecuacionesquimicas.html
- http://descargas.pntic.mec.es/cedec/proyectoedia/reanaturales/contenidos/es_magia/cmo_se_escriben_las_ecuaciones_qumicas.html

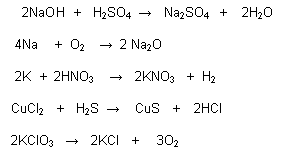

Comentarios
Publicar un comentario