NIVELACIÓN ALCOHOLES Y FENOLES
INTRODUCCIÓN

Su fórmula química es (C6H6O).
Para nombrar los fenoles se utiliza la terminación -ol precedida del nombre del hidrocarburo aromático correspondiente.
Si existen varios radicales -OH, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja en conjunto, si hay varias posibilidades decidirá el orden de preferencia alfabético de los radicales.; al nombrar los polifenoles, deben escribirse los localizadores y los prefijos correspondientes: di, tri, etc. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
La IUPAC admite algunos nombres comunes:
 Pirocatecol (1,2-bencenodiol ó 1,2-dihidroxibenceno ó o-difenol)
Pirocatecol (1,2-bencenodiol ó 1,2-dihidroxibenceno ó o-difenol)
 Resorcinol (1,3-bencenodiol ó 1,3-dihidróxibenceno ó m-difenol)
Resorcinol (1,3-bencenodiol ó 1,3-dihidróxibenceno ó m-difenol)
 Hidroquinona (1,4-bencenodiol ó 1,4-dihidróxibenceno ó p-difenol
Hidroquinona (1,4-bencenodiol ó 1,4-dihidróxibenceno ó p-difenol

Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.
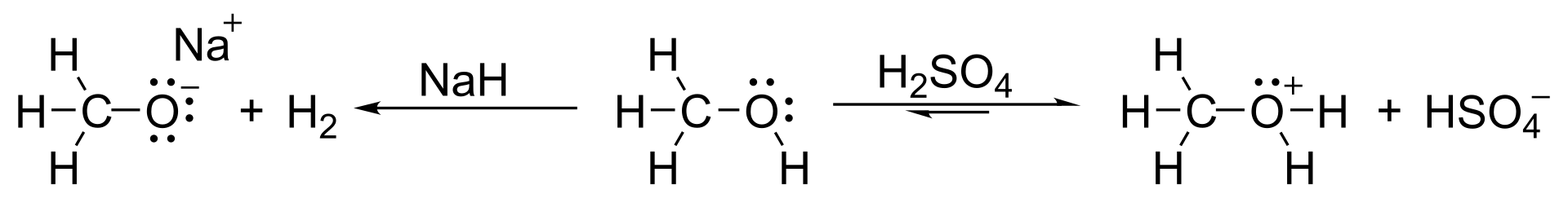
Para clorar alcoholes, se deben tomar en cuenta las siguientes consideraciones:
Los monoalcoholes derivados de los alcanos responden a la fórmula general (CnH2n+1OH)

En el presente trabajo se realizará una investigación sobre la Nomenclatura de Alcoholes y Fenoles en donde identificaremos su definición, formulación, propiedades, aplicaciones, nomenclatura y demás. También sus objetivos de los que se va a estudiar, identificando algunas imágenes que mostraremos a continuación y los ejercicios realizados en la página virtual con sus respectivas correcciones.
OBJETIVOS
- Identificar la definición y estructura de los Alcoholes y Fenoles.
- Poner en práctica constante los distintos ejercicios que nos presentan.
- Profundizar a cerca del tema tratado con su estructura, aplicaciones y demás.
MARCO TEÓRICO
FENOLES
El fenol (también llamado ácido carbólico, ácido fénico, alcohol fenílico, ácido fenílico, fenilhidróxido, hidrato de fenilo, oxibenceno o hidroxibenceno) en su forma pura es un sólido cristalino de color blanco-incoloro a temperatura ambiente. Tiene un punto de fusión de 43 °C y un punto de ebullición de 182 °C. El fenol es conocido también como ácido fénico, cuya Ka es de 1,3×10−10. Puede sintetizarse mediante la oxidación parcial del benceno. El fenol es una sustancia blanca, cristalina a temperatura ambiente, de color blanco-incoloro con un olor distintivo, acre y aromático. Recibe el nombre de fenol, el alcohol monohidroxílico derivado del benceno; dándosele, además, a todos los compuestos que tengan un radical oxidrílico unido al anillo bencénico. El fenol fue obtenido por Ruge en 1834; separó del asfalto lo que Él llamó ácido carbòlico. Nombre con el que se conoció hasta principios de este siglo. En 1914 Meyers y Bergius, proponen hidrolizar el monoclorobenceno con hidróxido de sodio. Proceso que se generalizó pocos años después. Hasta la Primera Guerra Mundial, solo se había logrado obtener el fenol ó ácido carbólico por la separación del asfalto; hasta que se estableció el proceso basado en la sulfonación del benceno hidrolizado con hidróxido de soldio, y volviendo a hidrolizar el producto, que era el bencensulfonato de sodio; a este se le llamó fenol sintético.
Usos y Aplicaciones:
- El fenol se usa principalmente en la producción de resinas fenólicas.
- se usa en la manufactura de nylon y otras fibras sintéticas.
- El fenol es muy utilizado en la industria química, farmacéutica y clínica como un potente fungicida, bactericida, sanitizante, antiséptico y desinfectante, también para producir agroquímicos, bisfenol A.
- En el proceso de fabricación de ácido acetilsalicílico (aspirina) y en preparaciones médicas como enjuagues bucales y pastillas para el dolor de garganta.
- El ácido fénico fue utilizado como antiséptico por el médico cirujano Joseph Lister, creador del método antiséptico, sin embargo esta sustancia irritaba la piel del enfermo y del cirujano, y fue sustituido más tarde por aceite fénico. Actualmente está en desuso. En la actualidad sigue utilizándose como cauterizador en ciertos procedimientos como la matricectomía por onicocriptosis.
- También se usa como desinfectantes (fenoles y cresoles), preparación de resinas y polímeros, preparación del ácido pícrico, usado en la preparación de explosivos, síntesis de la aspirina y de otros medicamentos.
Propiedades:
Químicamente, el fenol, se caracteriza por la influencia mutua entre el grupo Hidroxilo u Oxidrilo (HO:) y el Anillo aromático. El grupo fenilo ó fenil negativo, es la causa de una leve acidez del grupo oxidrílico (pK en solución acuosa a 25 ºC es 1.3 x 10 -10). En fenol reacciona con las bases fuertes para formar sales llamadas Fenóxidos (alguna veces fenonatos ó fenolatos): C6H5-OH + NaOH H2O + C6H5-ONa Los fenatos de sodio y potasio, son rápidamente descompuestos por el bióxido de azufre; éste compuesto, también descompone al fenol. El Grupo hidroxilo puede ser fácilmente eterificado y esterificado. El acetato de fenilo CH3 = COO = C6H5, el fosfato de trifenilo (C6H5)3PO4 y el salicilato de fenilo (C6H5)2O son los éteres comerciales más conocidos del fenol. El fenol es rápidamente oxidado a una variedad de productos que incluye a los Bancenodioles (hidroquinona, resorcinol y pirocatecol), bencenotrioles y derivados del difenilo (difenoles ó bifenoles) HO-C6H4-OH, y óxido de difenilo (dibenzofurano) y productos de descomposición, dependiendo este del agente occidente y de las condiciones de operación. La reducción del fenol con zinc por destilación, da Benceno, y la hidrogenación del fenol, finalmente, es método para la obtención del Ciclohexanol. El gurpo hidroxilo de una alta reactividad al grupo fenilo. Los átomos del hidrógeno en las posiciones o- (orto) y p- (para), con respecto del grupo hidroxilo, son altamente reactivos (orienta las sustituciones hacia esas posiciones); o sea, los hidrógenos en 2- y 4- son los primeros en ser sustituidas para formar el monodreivados para formar el monoderivado inicial, después el 2- 4- ó el 2- 6- derivado, y finalmente el 2- 4- 6- triderivado, esto si las condiciones lo permite.
Riesgos:
Vías de entrada: Inhalación de neblina o vapor; absorción cutánea de neblina, vapor o líquido. De ser ingerido en altas concentraciones, puede causar envenenamiento, vómitos, decoloración de la piel e irritación respiratoria. Era la sustancia utilizada en los campos de concentración nazis desde agosto de 1941 para disponer de las llamadas "inyecciones letales" (inyección de fenol de 10 cm3). Desafortunadamente es uno de los principales desechos de industrias carboníferas y petroquímicas; como consecuencia el fenol entra en contacto con cloro en fuentes de agua tratadas para consumo humano, y forma compuestos fenilclorados, muy solubles y citotóxicos por su facilidad para atravesar membranas celulares.
Comportamiento en el medio Ambiente:
- Agua
El fenol es más pesado que el agua y se hunde. Se disuelve lentamente y forma, incluso en dilución, soluciones tóxicas. En Alemania, el fenol se encuadra en el grupo de sustancias clasificadas como "Amenaza para el agua - Clase 2" debido a su considerable toxicidad en este medio.
- Aire
Los vapores son más pesados que el aire y, expuestos al calor, forman mezclas explosivas. La oxidación del fenol en el aire se acelera por efecto de la luz o de impurezas que actúan como catalizadores.
- Suelo
Debido a la degradación microbiana (aeróbica o anaeróbica) la acumulación de fenol en el suelo es escasa; el nivel de esta acumulación depende de la presencia de minerales arcillosos (gran afinidad con el óxido de aluminio).
Precaución:
- El estándar nacional es de 5 ppm (19 mg/m3)
Medidas de protección personal. En áreas donde pueden producirse salpicaduras del líquido deben usarse anteojos y ropa de protección. En zonas donde hay alta concentración de vapor deben utilizarse máscaras que cubran todo el rostro, con toma de aire suplementario, así como ropa de protección, guantes, botas de goma y delantal de hule.
Formulación:
Su fórmula química es (C6H6O).
Nomenclatura:
Para nombrar los fenoles se utiliza la terminación -ol precedida del nombre del hidrocarburo aromático correspondiente.
Si existen varios radicales -OH, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja en conjunto, si hay varias posibilidades decidirá el orden de preferencia alfabético de los radicales.; al nombrar los polifenoles, deben escribirse los localizadores y los prefijos correspondientes: di, tri, etc. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
La IUPAC admite algunos nombres comunes:
 Pirocatecol (1,2-bencenodiol ó 1,2-dihidroxibenceno ó o-difenol)
Pirocatecol (1,2-bencenodiol ó 1,2-dihidroxibenceno ó o-difenol) Resorcinol (1,3-bencenodiol ó 1,3-dihidróxibenceno ó m-difenol)
Resorcinol (1,3-bencenodiol ó 1,3-dihidróxibenceno ó m-difenol) Hidroquinona (1,4-bencenodiol ó 1,4-dihidróxibenceno ó p-difenol
Hidroquinona (1,4-bencenodiol ó 1,4-dihidróxibenceno ó p-difenol
Los radicales de los fenoles Ar - O -, se nombran añadiendo la terminación -oxi al nombre del radical: (C6H5) - O -, fenoxi, etc.
ALCOHOLES
Son aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno, de un alcano, enlazado de forma covalente a un átomo de carbono, grupo carbinol (C-OH). Además este carbono debe estar saturado, es decir, debe tener solo enlaces sencillos a ciertos átomos (átomos adyacentes). Esto diferencia a los alcoholes de los fenoles. Si contienen varios grupos hidroxilos se denominan polialcoholes (Los polialcoholes, polioles o “alditoles”, son substancias cuya estructura consiste en una cadena carbonada con un grupo OH sobre cada uno de los carbonos. Los alcoholes forman una amplia clase de diversos compuestos: son muy comunes en la naturaleza y a menudo tienen funciones importantes en los organismos. Los alcoholes son compuestos que pueden llegar a desempeñar un papel importante en la síntesis orgánica, al tener una serie de propiedades químicas únicas. En la sociedad humana, los alcoholes son productos comerciales con numerosas aplicaciones, tanto en la industria como en las actividades cotidianas; el etanol, un alcohol, lo contienen numerosas bebidas.

Usos y Aplicaciones:
- Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias textiles, colorantes, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas y barnices.
- También se usan como productos de limpieza, aceites y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
- La industria química lo utiliza como compuesto de partida en la síntesis de productos como el acetato de etilo (un disolvente para pegamentos, pinturas, etc).
- También se aprovechan sus propiedades desinfectantes.
- El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil.
Propiedades:
Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.

1. Halogenación de Alcoholes: Para fluorar cualquier alcohol se requiere del reactivo de Olah o el reactivo de Ishikawa
- Alcohol primario: Los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
- Alcohol secundario: Los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
- Alcohol terciario: Los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
2. Oxidación de Alcoholes:
- Metanol: Existen diversos métodos para oxidar metanol a formaldehído y/o ácido fórmico, como la reacción de Adkins-Peterson.
- Alcohol primario: se utiliza la piridina (Py) para detener la reacción en el aldehído Cr03/H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 10 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza un enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
3. Deshidratación de Alcoholes: La deshidratación de alcoholes es un proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua. Si se requiere deshidratar un alcohol en condiciones más suaves se puede utilizar el reactivo de Burgess.
Fuentes:
Muchos alcoholes pueden ser creados por fermentación de frutas o granos con levadura, pero solamente el etanol es producido comercialmente de esta manera, principalmente como combustible y como bebida. Otros alcoholes son generalmente producidos como derivados sintéticos del gas natural o del petróleo.
Formulación:
Nomenclatura:
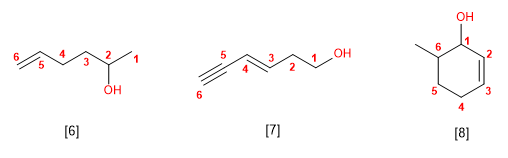
Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

Regla 2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.

Regla 3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol

Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.

Regla 5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.

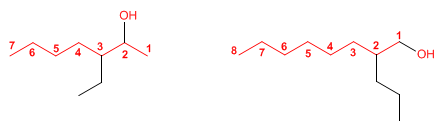
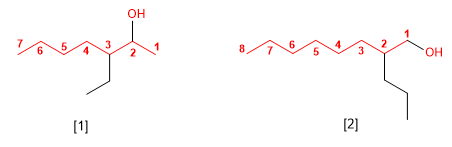
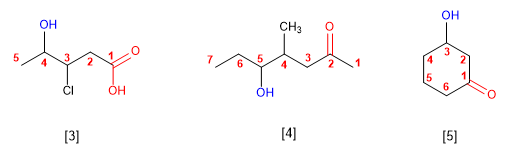
SOLUCIÓN DE EJERCICIOS
WEBGRAFIA



















NO VEO LAS REGLAS DE NOMENCLATURA Y FALTAN EJERCICIOS 4,0
ResponderEliminar